血压不降、麻药不睡?药监部门就集采药品问题答问(3)
总的来看,此次关于“血压不降、麻药不睡、泻药不泻”等说法,多来自他人转述和主观感受。下一步,有关部门将持续关注。接受调研的一位临床专家也当场表示,“对制药行业特别是对仿制药行业不够了解,就容易产生‘价格等于质量’‘降价就一定降质’的认识误区”。
问:社会上对药监部门针对仿制药的一致性评价是否为“一次性评价”非常关心,能否介绍一下一致性评价的有关情况?
答:从2015年开始,我国推进药品审评审批制度改革,将仿制药由原来的“仿已有国家标准的药品”调整为“仿与原研药品质量和疗效一致的药品”。对早期上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行一致性评价。
首先,严格遴选一致性评价参比制剂。一般选择原研药品作为参比制剂,也就是说一致性评价的对照药品是唯一的,所有仿制药都以参比制剂作为对照。有人担心 “首仿以原研为参照、后续仿制药再以首仿为参照导致仿制标准下降”的问题不存在。
第二,我国的一致性评价方法采用了国际公认的严格标准。我国的仿制药一致性评价技术要求已与国际接轨,采纳国际人用药品注册技术协调会(ICH)等国际通行技术标准开展仿制药的技术审评,包括药学、非临床、临床等,已经采纳实施了全部ICH技术指导原则。欧美等发达国家也是采用上述技术标准开展审评。参照欧美药品监管机构的做法,在依法保护企业商业秘密的基础上,公开审评报告。
第三,药品过评上市后持续受到严格监管。药监部门不仅在上市审评审批时坚持严格标准,在药品过评上市后仍然坚持严格监管,要求企业严格按照申请一致性评价时的工艺生产,重大变更须重新审批。上市后变更的审评标准也与国际接轨,持有人需要按照ICH Q8(R2)药品研发、ICH Q9(R1)质量风险管理、ICH Q10药品质量体系及ICH Q12药品生命周期管理的技术和监管考虑等,持续改进和优化药品质量。因此,一致性评价是一整套质量评价和监管体系,不是“一次性评价”。
推荐阅读

四川筠连首份滑坡实景模型构建完成 助力救援决策
央视新闻客户端2025-02-09 14:12:50
中国队包揽亚冬会自由式滑雪男子空中技巧前四名
央视体育2025-02-09 13:50:16
中国队夺得亚冬会短道速滑女子3000米接力金牌
央视体育2025-02-09 13:46:47
非洲领导人呼吁立即在刚果金停火 东共体与南共体联合会议
新华社2025-02-09 14:24:50
一公交车与站台碰撞致2死1伤 驾驶员突发疾病引发悲剧
光明网2025-02-09 14:00:58
巴特勒球衣印“三世”字样悼念父亲 首秀表现亮眼
直播吧2025-02-09 15:02:19
特朗普拿武器换乌稀土背后有何打算 美国对外援助模式转变
生活与逻辑分享2025-02-09 09:41:19
军事专家:《蛟龙行动》专业又震撼 潜艇细节获高分好评
新黄河2025-02-09 09:44:46
张楚桐获短道速滑女子1000米季军 亚冬会佳绩
新华社2025-02-09 14:45:37
本轮巴以冲突致加沙48181人死亡 伤亡人数持续上升
央视新闻2025-02-09 09:38:52
马斯克又盯上消费者金融保护局 意图引发争议
腾讯新闻2025-02-09 09:39:05
美国宇航员:没有被抛弃的感觉,积极工作创纪录
看看新闻2025-02-09 09:39:20
石破茂如何在中美之间寻求外交平衡 微妙心态与策略调整
生活与逻辑分享2025-02-09 09:40:55
特朗普为对华玩“先兵后礼”,急于启动并不成熟的“分散式作战” 军事调整引发关注
网易2025-02-09 09:48:10
有影院靠《哪吒2》7天赚了半年的钱 影院迎来久违的春天
凤凰网财经2025-02-09 13:54:56
中国队女子3000米接力金牌 范可新等四将摘金
中国青年网2025-02-09 15:20:54
美议员抨击特朗普加沙计划荒谬至极 引发两党质疑
红星新闻2025-02-09 09:45:18
泽连斯基向美国亮出稀土地图 寻求矿产合作诚意
红星新闻2025-02-09 09:48:25
碘伏没有那么“万能” 正确使用很重要
北青网2025-02-09 14:01:54
专家:乌军以拖待变盼美支援 等待外交转机
郭宣翻译2025-02-09 09:40:31
山东烟台:游客雪中赏鸥 与海鸥亲密互动
中国新闻网2025-02-09 14:33:40
韩国队犯规 干扰导致中国队无缘金牌
观察者网2025-02-09 14:34:13
勇士vs公牛述评:巴特勒完美首秀 双核接力大逆转
直播吧2025-02-09 15:01:49
重庆轨道交通项目全面复工 施工现场热火朝天
上游新闻2025-02-09 14:29:40
喀什警方辟谣捡钱包谣言 旧谣新传再起波澜
光明网2025-02-09 14:43:12
学者:加州州长扛起反特朗普大旗 纽森签署“防特朗普”法案
刘庆彬研究员2025-02-09 13:54:45
特鲁多:特朗普“吞并加拿大”的威胁“是真的” 加方回应关税挑战
环球时报2025-02-09 10:25:27
申花外援特谢拉晒照庆祝超级杯夺冠 特别夜晚见证努力与热情
直播吧2025-02-09 14:43:42
中方驳斥关于中柬关系的不实言论 坚定捍卫铁杆友谊
中国青年报2025-02-09 09:48:42
独行侠主帅:理解球迷抗议,比赛专注篮球
直播吧2025-02-09 15:19:02
泽连斯基大嘴一张:派兵、归还核武!引发国际争议
环球时报热点2025-02-09 10:25:56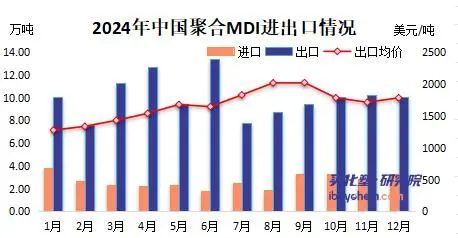
美对华化工关税大棒最终砸的是谁 美国自身利益受损
新浪2025-02-09 09:42:35
比尔·盖茨:别低估中国的创新能力 科技崛起引全球瞩目
轩俊聊科技2025-02-09 09:44:59
张伟丽:感谢大家对我的支持,再次卫冕金腰带
懂球帝2025-02-09 15:17:16
外媒称哪吒2爆火是因中国人没钱旅游 票房神话揭示观众真需求
网易2025-02-09 09:50:20